5 家中国药企可仿制生产辉瑞口服新冠药,但要上市还需过这些关
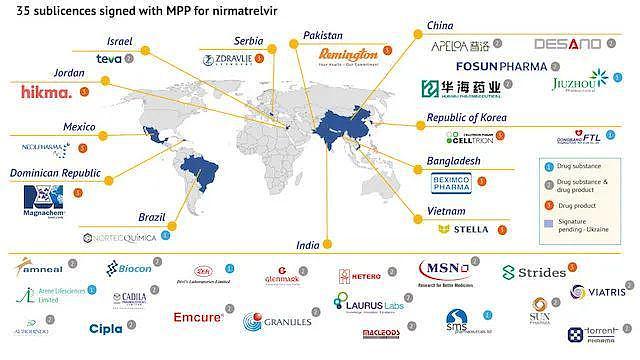
当地时间 3 月 17 日,药品专利池组织(Medicines Patent Pool, MPP)宣布,与 35 家企业签订协议,授权其生产辉瑞口服新冠治疗药物奈玛特韦(nirmatrelvir,即 PF-07321332)仿制药,这其中包括了 5 家中国药企。
具体的这 5 家中国药企中,上海迪赛诺、华海药业 ( 600521.SH ) 、普洛药业 ( 000739.SZ ) 、复星医药 ( 600196.SH、02196.HK ) 这四家企业生产奈玛特韦原料药和成品药,九洲药业则生产奈玛特韦原料药。
上述这些企业获得授权生产后,产品要上市的话,还需要经过哪些环节呢?
授权生产奈玛特韦
此次获得授权的企业主要供应的是 95 个中低收入国家,这些国家共覆盖全球约 53% 人口。值得注意的是,中国并不在供应范围内。
奈玛特韦 / 利托那韦组合包装(PAXLOVIDTM)是一款由辉瑞公司开发的组合包装口服新冠治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎 ( COVID-19 ) 患者。截至目前,该药已在全球约 40 个国家获得批准上市。
在奈玛特韦 / 利托那韦组合包装的活性药物成分中,奈玛特韦是一种新冠病毒主蛋白酶(MPRO,也被称为 3CL 蛋白酶)抑制剂,其与低剂量的利托那韦组合给药,有助于减缓奈玛特韦的代谢或分解,使其在较高浓度下在体内保持较长时间的活性,以帮助对抗新冠病毒。
据了解,本次非独家分许可并不包括药物利托那韦的生产,利托那韦是一种 HIV-1 蛋白酶抑制剂和 CYP3A 抑制剂,因其专利权已到期,生产该药物无需原专利权人许可,获授权的企业需自行解决药物利托那韦的供货。
此次授权生产的是奈玛特韦原料药或者产品药。根据 MPP 官方新闻稿,本次非独家分许可允许获授权的企业生产辉瑞新冠口服药奈玛特韦原料药及其成品药与利托那韦组合包装。MPP 同时在其新闻稿中表示,本次获许可的企业证明了他们有能力满足 MPP 对生产能力、监管合规以及生产质量符合国际质量标准的药品的要求。
药品专利池组织(MPP)是一家由联合国支持的非营利性公共卫生组织,其通过自愿许可和专利池的创新方法,致力于增加中低等收入国家获得药品的机会,并促进此类药品的开发。2021 年 11 月,MPP 与辉瑞签署了一项自愿许可协议,根据该协议条款,MPP 获辉瑞许可,可以再向其他制造商授予非独家分许可,为 MPP 许可覆盖的 95 个中低收入国家生产并供应有质量保证的口服新冠治疗药物奈玛特韦仿制药,覆盖全球约 53% 的人口。此外,基于该协议条款,只要新冠肺炎仍被世界卫生组织列为 " 国际关注的突发公共卫生事件 ",辉瑞将不会从奈玛特韦在协议区域内的销售中收取专利许可使用费。
何时才可以上市
在抗击新冠疫情中,因服用方便,新冠口服药被寄予厚望。
对于获得生产辉瑞新冠口服药的企业而言,最终产品可以上市,还需要闯多重关。
第一是仍要解决另外一款原料药利托那韦的供应问题。利托那韦的原研厂家是艾伯维,该药在仿制上面临一定的难度。由于利托那韦是难溶性的药物,很难获得与原研药品的人体内生物等效。中国企业中,共有三家企业拿到了利托那韦的中国上市许可证,但也只有一家是通过了生物等效性研究,该企业是歌礼制药,其利托那韦口服片于去年 9 月获批在中国上市。与此同时,该公司已经递交了 12 个欧洲国家(德国、法国、爱尔兰、英国、西班牙、葡萄牙、意大利、比利时、波兰、瑞典、荷兰和丹麦)利托那韦上市许可申请。
" 利托那韦口服片的生物等效性研究非常难做,门槛很高,需要耗费四年左右的时间才能完成。公司通过多年的不懈努力,使用高端制剂技术,大幅度提高难溶性利托那韦在人体内的生物利用度,从而达到与艾伯维生产的原研口服片在人体中的生物等效。纵观全球药企中,目前可以生产利托那韦且通过生物等效性研究的并不多,除了公司外,印度也有一两家,且也通过了生物等效研究,另外,美国也有一两家企业,但产能并不多。" 近期,歌礼制药董事长吴敬梓对第一财经记者表示。
不过,近日歌礼亦宣布利托那韦口服片年产能进一步扩大至约 5.3 亿片,目的是提供产能保障。
第二,仿制的辉瑞口服新冠药上市,仍需要经过一系列审批流程,如通过当地国家的注册申请。
在辉瑞口服新冠药物放开仿制之前,另外一家跨国药企默沙东也与 MPP 达成了一项许可协议,以增加口服小分子新冠药物 Molnupiravir 在中低收入国家的广泛使用。今年 1 月份,MPP 已与 27 家企业签订协议,为全球 105 个中低收入国家或地区生产及供应口服抗新冠病毒药物 Molnupiravir 仿制药,其中,就有 5 家中国企业上榜。
这 5 家企业分别是复星医药、博瑞医药、维亚生物旗下朗华制药、石家庄龙泽制药和上海迪赛诺,其中除朗华制药被授权生产原料药,另外 4 家中国药企均可以同时生产原料药和成品药。截至目前,这些获得仿制的企业也尚未公布产品上市。多家药企也曾表示,本次许可项下合作药物在商业化生产前,尚需完成相关技术交接且生产设施需经 SRA 批准或通过 WHOPQ 认证。本次许可项下合作药物在区域内的生产、销售等,须待相关主管机构批准(包括但不限于上市批准)后方可实施。
不过,对此次获得可以生产辉瑞口服新冠药的企业而言,有个别企业已具备全球化销售优势。
如复星医药经过在非洲等新兴市场超 15 年的运营,已在非洲 39 个英语和法语国家及东南亚地区建立了成熟的销售网络,这和 MPP 设定的全球中低收入国家在地域上有很好地重合。在这些区域,该公司也有很好的创新药和仿制药商业化经验,包括注册、分销、促销、药物安全警戒。





 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


